Nature Genetics │IF 41.037│嘉因生物CUT&Tag和ATACseq助力核酸甲基化转录调控研究
整合染色质可及性、转录因子和表观遗传修饰的转录调控对于建立和维持细胞身份至关重要。然而,在调节染色质可及性和基因转录方面,RNA 修饰是否以及如何与 DNA 甲基化相互作用尚不清楚。2022年9月7日,中山大学肿瘤中心林东昕/郑健团队、美国希望之城国家医学中心贝克曼研究所陈建军团队合作,在Nature Genetics 杂志在线发表题为“RNA m6A regulates transcription via DNA demethylation and chromatin accessibility”的研究论文,该研究表明 METTL3 介导的 RNA m6A形成导致正常细胞和癌细胞中附近基因组位点的 DNA 去甲基化,这是由 m6A 读取器 FXR1 和 DNA 5-甲基胞嘧啶双加氧酶 TET1 之间的相互作用介导的。文中CUT&Tag和ATACseq由嘉因生物协助完成。


RNA m6A水平与DNA 5mC水平呈负相关
首先系统地分析公共数据集,作者发现在CpG岛上DNA甲基化修饰水平与m6A peak的距离成反比,提出RNA m6 A与DNA 5mC负相关,但机制不明。METTL3是m6A修饰的关键酶,因此作者检测了METTL3敲除后DNA 5mC 水平,发现,METTL3的缺失导致整体DNA 5mC水平和5mC/C比值显著增加(图1a,b)。在METTL3缺失的细胞中,野生型METTL3的外源表达可以rescue DNA 5mC 水平,但对于METTL3突变体则不能(图1b)。敲除METTL3导致整体显著降低RNA m6 A水平,更高的整体DNA 5mC水平(图1c,d)以及更多的高甲基化差异甲基化区域(DMRs)(图1d)。在RNA m6 A附近的高甲基化DMRs中的DNA 5mC水平在METTL3耗尽后,距离CpG岛 to m6 A的距离越大峰值下降(图1e)。然后,我们将差异甲基化区域定位到最近的基因上,发现超过80%的具有低m6a峰的基因也包含超DMR簇(图1g)。这表明METTL3缺失和DNA 5mC的增加与RNA m6A有关。
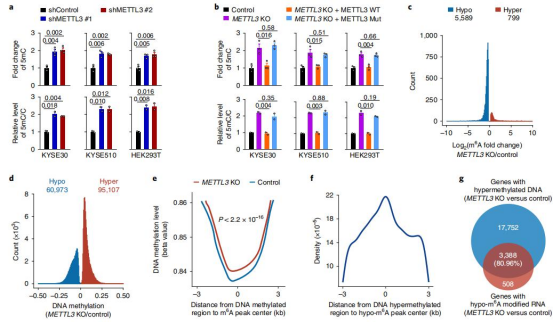
图1 RNA m6A修饰水平与DNA 5mC水平呈反相关性
TET1活性与全基因组RNA m6A水平相关
作者使用CUT&Tag检测了METTL3和TET1在细胞中的染色质上分布情况,综合分析显示,TET1结合与m6A水平呈正相关(图2a,b)。我们发现>为65%的TET1靶基因有m6A(图2c)。METTL3 CUT&Tag信号强度与TET1信号强度呈正相关(图2d)。大部分TET1(97.1%)与METTL3共定位(图2g),并集中于METTL3峰的中心(图2f)。METTL3敲除,表明TET1和METTL3在此过程中具有协同作用。进行了5hmC-Seal分析,发现5hmC水平显著降低,但也可以被野生型的外源表达充分逆转,而不是突变型的METTL3(图2g)。低5hmC峰主要位于超dmrs中心(图2h)和m6A峰中心(图2i)。在METTL3缺失导致的低甲基化基因中,大多数低5hmC基因具有高5mC(图2j),进一步证明了METTL3沉积的m6 A修饰在TET1介导的DNA去甲基化中共存。
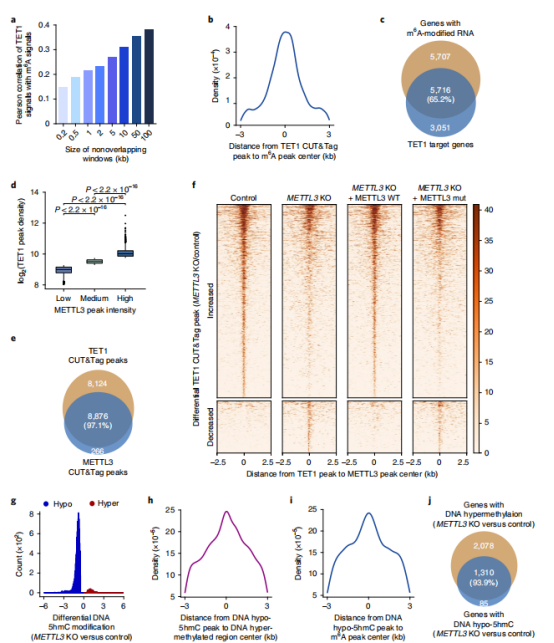
图2 DNA去甲基化酶TET1的活性与全基因组RNA m6A水平相关
m6A共转录引导TET1去5mC甲基化
由于RNA m6A是共转录形成的,而TET1在转录过程中与RNA聚合酶II(Pol II)相关,作者发现82.9%的TET1结合位点被Pol II靶向(图3a),而TET1定位于Pol II的中心(图3b)。Pol II抑制剂处理的细胞显示TET1染色质结合显著减少(图3c)。METTL3缺失也会导致TET1染色质以m6 A甲基转移酶依赖的方式结合减少(图3d)。
图3 m6 A共转录引导TET1去甲基化5mC。
FXR1,已经有报道是一个m6A阅读器,具有最高的基于强度的绝对量化(iBAQ)评分(图4a)。Western blot分析显示,TET1和FXR1之间存在直接的DNA和RNA支架独立的相互作用,但其他核蛋白之间没有相互作用(图4b)。与之前的报道一致,FXR1优先与m6A修饰的RNA结合,但敲除KH结构域阻碍了其结合(图4c)。大部分FXR1结合位点与m6A峰的中心一致,并位于其中心(图4d)。FXR1-DNA相互作用的位置与其RNA结合位点显著一致(图4e)。进一步分析CUT&Tag数据,显示大多数FXR1和TET1结合区域重叠(图4f),并呈正相关(图4g、h)。FXR1的缺失显著增加了DNA 5mC,降低了TET1的结合,这可以通过恢复FXR1的表达来rescue(图4i,j)。在METTL3敲除细胞中使用dPspCas13b-FXR1融合蛋白验证了这些结果,结果显示,当该蛋白与引导RNA指向定义的靶点时(图4k)时,TET1也被募集(图4l),导致DNA 5mC水平下降(图4m)。
图4 FXR1募集TET1来去DNA甲基化
m6A-5mC相互作用在转录调控中发挥作用
RNAseq结果显示,细胞中许多差异表达的RNA(709个上调,948个下调)与METTL3、TET1或FXR1减少重叠(图5a)。TET1或FXR1敲除导致METTL3敲除一样获得或失去可及性,表明METTL3、FXR1和TET1具有协同效应(图5b)。可及性的增加与基因转录量的增加显著相关,可及性的缺失与基因转录水平的减少相对应(图5c)。在高甲基化的DMRs中也发现了类似的结果(图5d)。
图5 RNA m6A的形成与DNA去甲基化结合,在染色质状态和基因转录中起作用
在人类原代组织中验证,发现ESCC的DNA甲基化水平明显低于邻近正常组织,但m6A水平明显高于邻近正常组织(图6a,b),这与之前结果一致。大多数RNA m6A峰(64.7%)在±2000bp区域内有CpG岛,其中65.4%的m6A水平与每个峰范围内CpG岛的甲基化水平呈负相关(图6c)。在甲基化水平与m6A峰呈负相关的CpG岛中,TET1或FXR1 RNA水平与DNA甲基化水平之间的相关性更强(图6d,e)。在ESCC中鉴定了368个与RNA m6A高甲基化和DNA低甲基化相关的基因;其中,80%的基因在ESCC中的表达水平高于邻近正常组织(图6f)。基因的功能注释显示,大量存在丰富的经典癌症相关通路,如癌症中的转录失调、PI3K-AKT和TGF-β通路(图6g)。
图6 ESCC中RNA m6A形成结合DNA去甲基化对转录调控的验证

该研究报道了 METTL3 介导的RNA 中 m6A的形成在调节DNA 甲基化和染色质可及性中起重要作用。研究发现RNA m6A 引导DNA 5mC 去甲基化,从而重新编程染色质可及性和基因转录。这一发现揭示了生物过程中 RNA 甲基化与DNA 去甲基化相结合的表观遗传调控,证明了m6A-5mC 串扰在染色质可及性和基因转录中的作用,并将这一调控过程定义为 RNA 甲基化偶联的 DNA 去甲基化。这种机制提出了基因转录的表观遗传机制的概念,对疾病状态与正常状态下的细胞转录调控提供崭新的理解。
RNA m6A 形成与 TET1 介导的 DNA 去甲基化在染色质重塑和基因转录中的工作模型
